Los cuestionamientos éticos a los ensayos clínicos de vacunas COVID-19 en Latinoamérica
Tras seis meses de la declaratoria de pandemia, se ha hecho evidente la falta de transparencia alrededor de los acuerdos alcanzados entre los Gobiernos de la región y las empresas para la práctica de ensayos clínicos.
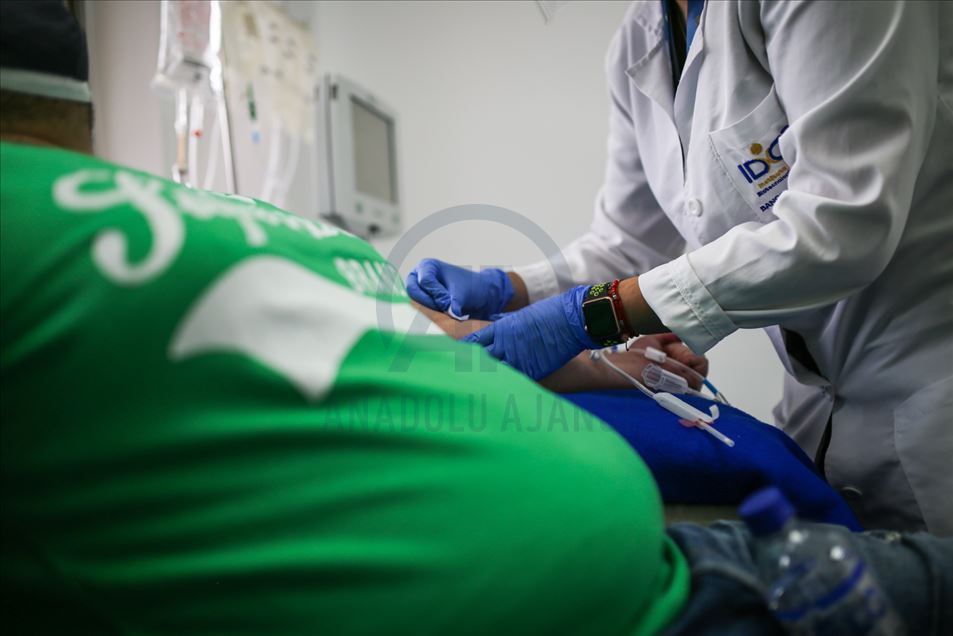
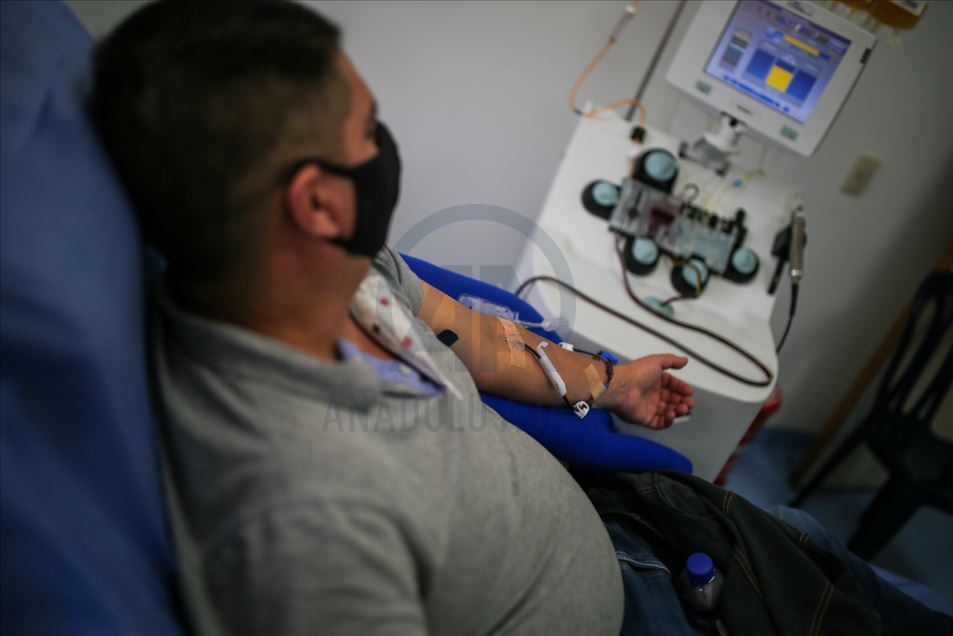
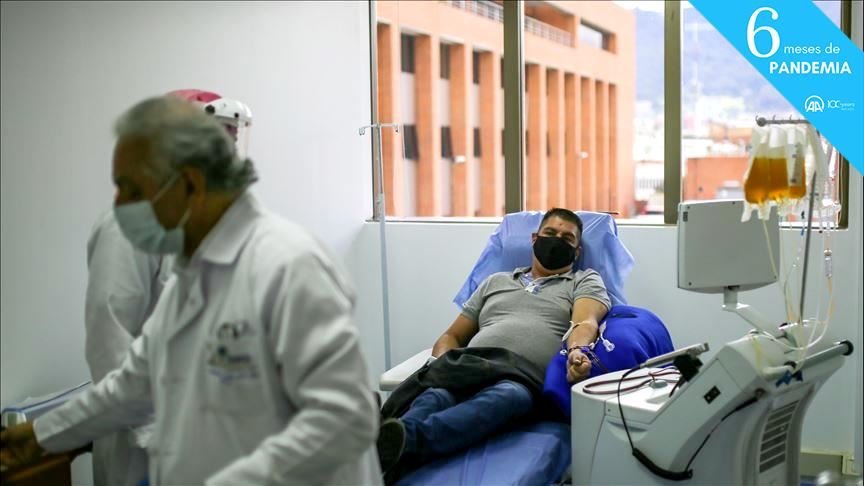 Trabajadores de la salud recolectan plasma de personas que se han recuperado del coronavirus (COVID-19), en el Instituto Distrital de Ciencia, Biotecnología e Innovación en Salud (IDCBIS), en Bogotá, Colombia, el 20 de agosto ce 2020. (Juancho Torres - Agencia Anadolu)
Trabajadores de la salud recolectan plasma de personas que se han recuperado del coronavirus (COVID-19), en el Instituto Distrital de Ciencia, Biotecnología e Innovación en Salud (IDCBIS), en Bogotá, Colombia, el 20 de agosto ce 2020. (Juancho Torres - Agencia Anadolu)
Colombia
Por: Sergio García Hernández
A seis meses de la declaración de la pandemia del coronavirus (COVID-19), varias empresas de la industria farmacéutica del mundo han llegado a la fase 3 de sus investigaciones en el desarrollo de una vacuna, donde se realizan ensayos clínicos en miles de personas. Varias de las compañías han puesto sus ojos en países de Latinoamérica para la realización de la decisiva etapa durante la cual se comprueba la efectividad y se descartan los posibles eventos adversos del producto.
Aunque la localización donde se hará la gran cantidad de ensayos clínicos se explica porque el foco de la pandemia se encuentra en los países latinoamericanos, la decisión encuentra unos cuestionamientos éticos que surgen debido a los estándares bajo los que se realizarían dichos experimentos.
Claudia Vaca, directora del Centro de Pensamiento Medicamentos, Información y Poder de la Universidad Nacional de Colombia, considera que en medio de la pandemia se ha hecho evidente la falta de transparencia alrededor de los acuerdos alcanzados entre los Gobiernos y las empresas para la práctica de los ensayos clínicos.
Ver también: Los avances y retos de Colombia para acceder a una vacuna contra la COVID-19
“Por ejemplo, en Colombia se anunció de una manera amplia la incorporación de colombianos en el ensayo clínico con la empresa Johnson y Johnson. Pero hasta el momento no se tiene acceso al protocolo completo de la investigación”, explicó Vaca a la Agencia Anadolu.
La investigadora detalló que el problema de que no se conozca en detalle la información sobre los ensayos clínicos es que no queden claros "aspectos fundamentales" que garanticen que las vacunas son seguras para los seres humanos.
“La información y los protocolos clínicos son de interés público. Son herramientas para que la comunidad médica y científica pueda evaluar con independencia la forma como se están ensayando estas vacunas y si son útiles para combatir la pandemia y garantizar la inmunización de la población que lo necesite”, indicó Vaca.
Para la experta, los ensayos clínicos de la fase 3 deben hacerse bajo estándares que den cuenta, entre otros aspectos, de las condiciones de las pólizas de cobertura para los voluntarios, así como de los tiempos de seguimiento a la evolución de la vacuna para detectar posibles anomalías.
“A nivel mundial, varias organizaciones han pedido transparencia en la investigación clínica para que todos los datos sean de acceso a la ciudadanía y así hacer seguimiento, monitoreo y control social y político”, explicó Vaca.
A la investigadora le inquieta, además, que hay países latinoamericanos que pareciera que han incorporado la cantidad de voluntarios en la fase 3 de las investigaciones como un criterio relevante en sus negociaciones con las farmacéuticas para la adquisición de las vacunas.
“Estamos hablando de una contrapartida de acceso prioritario por el hecho de haber participado en los ensayos clínicos. Este trueque de acceso prioritario, versus pacientes enrolados, nunca se había visto de una manera tan evidente y sería inaceptable”, aseveró.
Vaca remarcó que el “cuestionamiento ético fundamental” es que el desarrollo de la vacuna esté dominado por el interés de las empresas de acceder a los mercados para que sus productos tengan una cobertura mayor y mejores oportunidades de negocio auspiciados, en muchos casos, por acuerdos de confidencialidad.
En medio de ese contexto que deja la carrera por la vacuna, la reciente pausa en los ensayos clínicos anunciada por la empresa británica AstraZeneca, debido a un evento adverso en uno de sus voluntarios, deja algunas lecciones importantes sobre el valor que tiene la ética.
AstraZeneca anunció una situación que es posible que suceda en medio de los ensayos clínicos y que muestra que la investigación de una vacuna puede tener contratiempos que, aunque válidos, la sociedad tiene derecho de conocer.
“En el caso de los eventos adversos, la industria farmacéutica no puede ser la que evalúe la causalidad, tienen que ser otras entidades con la independencia para poder hacerlo”, mencionó Vaca, sobre la lección que deja el caso de la compañía británica.
Los principales laboratorios del mundo que han llegado a la fase 3 en el desarrollo de una vacuna contra el coronavirus han decidido hacer sus ensayos clínicos en países latinoamericanos que se han ofrecido para el reclutamiento de voluntarios. Los ofrecimientos coinciden cuando naciones como México y Brasil continúan con elevadas cifras diarias de casos, mientras que otros como Argentina y Colombia transitan por lo que varios epidemiólogos han definido como el pico de la pandemia.
Brasil, Perú, Chile, Colombia, México y Argentina anunciaron, a finales de agosto pasado, acuerdos para hacer parte de los ensayos clínicos que realizará la empresa estadounidense Johnson & Johnson y su grupo de compañías farmacéuticas, Janssen.
Ver también: Latinoamérica, epicentro mundial de los ensayos clínicos de vacunas contra la COVID-19
La farmacéutica china Sinopharm ha acordado con Perú y Argentina realizar ensayos clínicos con sus poblaciones. La empresa AstraZeneca, que trabaja en alianza con la Universidad de Oxford en el Reino Unido, también ha pactado hacer sus experimentos de la fase 3 en miles de personas en Brasil y Perú.
La vacuna rusa llamada Sputnik-V, que fue la primera en el mundo en registrarse oficialmente como efectiva ante la enfermedad, tendrá unas nuevas pruebas en pacientes tanto de Venezuela como de México.
Otras empresas que han anunciado que realizarán los ensayos clínicos de sus vacunas en la región latinoamericana son la farmacéutica estadounidense Pfizer; la china Sinovac y la compañía alemana BioNTech. Con las dos primeras, Brasil ha accedido hacer parte de sus estudios mientras que Argentina tiene acuerdos con la firma europea y la norteamericana.
El sitio web de la Agencia Anadolu contiene sólo una parte de las historias de noticias ofrecidas a los suscriptores en el Sistema de Difusión de AA News (HAS), y en forma resumida.